과산화수소를 이용한 NOx 산화반응 특성 연구
초록
최근 사회적 문제로 대두되고 있는 대기오염물질인 미세먼지의 경우, 이차 생성원인 전구물질(SOx와 NOx)을 저감하기 위한 연구가 대두되고 있다. 황산화물의 경우 습식스크러버를 사용하여, 대부분이 처리된다. 이를 해결하기 2차 생성가스를 입자화하여 필터로 처리하는 연구가 진행되고 있다. 입자화의 방법을 촉진하기 위한 방안으로 오존 투여 방법이 있으나, 이 방법은 오존의 2차 오염물질 생성과 고비용의 오존생성기로 인하여, 오존의 투입은 어려운 상황이다. 이를 해결하기 위해 농도가 낮은 과산화수소를 이용하여, 입자화를 촉진하는 방법이 있다. 본 연구는 입자화 촉진을 위해 과산화수소가 Sus, Quartz 반응기에서의 산소발생량 측정하여 비교하였다. Sus 재질의 반응기보다 Quartz 재질의 반응기가 반응성에 훨씬 더 안정적이며, H2O2/NO 비율은 3 이상일 경우부터 산화가 잘되는 것을 확인하였다. 높은 NO2 전환율은 반응온도 400℃, NO 저감은 S.R = 3일 때, 최대 40%의 효율을 이루어냈다.
Abstract
In recent, reducing the precursor such as Nitrogen oxides (NOx) and the sulfur oxides (SOx) are issues in Korea for air pollution problems. The majority of sulfur oxides (SOx) are reduced by wet-scrubber. To solve this problem, the direct conversion of NOx in flow gas with ammonia which can be possibly scrubbed by filter. The ozone gas is used to activate conversion of NOx. However, it is difficult to use in commercial system due to second air polution by ozone and high cost for ozone generator. Therefore, the peroxide (H2O2) is suggested to activate conversion of NOx which replacing ozone gas. This study compared the oxygen generation capacity of hydrogen peroxide in Sus and Quartz reactors for particle agglomeration promotion. The Quartz reactor demonstrated greater reactivity and stability compared to the Sus reactor. It was observed that effective oxidation occurs when the H2O2/NO ratio exceeds 3. A high NO2 conversion rate of up to 40% efficiency was achieved at a reaction temperature of 400℃, and the maximum reduction of NO was achieved at an S.R of 3.
Keywords:
NOx, Oxidation, Reduction, Hydrogen Peroxide (H2O2), Oxidation Conversion키워드:
질소산화물, 산화, 환원, 과산화수소, 산소발생량1. 서 론
최근 사회적 문제로 대두되고 있는 대기오염물질인 미세먼지의 경우 화력발전소나 산업체 연소시설에서 화석연료를 연소시키거나 자동차 배기가스 등에서 주로 배출되고 있는 실정이다. 미세먼지는 연돌 등 발생원에서부터 고체 상태로 배출되는 경우와 발생원에서는 가스 상으로 배출되지만 대기 중에서 화학반응에 의해 미세먼지 화 되는 경우로 구분된다. 최근 국내에서 석탄화력 발전소에서의 미세먼지 배출이 사회적인 주요 이슈로 부각되면서, 발전소에서 배출되는 미세먼지를 최대한 억제하기 위한 처리시스템 개발이 지속적으로 요구되고 있다.1) 특히 화력발전소로부터 초미세먼지뿐만 아니라, 원인 물질인 황산화물(SOx), 질소산화물(NOx)이 다량 배출되고 있어, 정부에서는 세계 최고 수준의 배출허용기준을 추진하고 있다. 황산화물 제어 기술은 대부분 석회를 이용한 습식 스크러버이다. 그 중 질소산화물은 연소 배기가스 용해도가 낮기 때문에 현재 이들 스크러버 시스템에서 질소산화물을 효과적으로 제거하기 쉽지않다. 연도가스 중 배출되는 대부분의 가스가 NOx이며, 이 중 대부분은 NO이며, 이는 거의 용해되지 않기 때문에 스크럽하는 것은 사실상 불가능하다. 이것을 해소하기 위하여, SCR로 일부 해결하고 있으나, 추가적인 방법이 필요한 실정이다. 이를 해결하기 2차 생성가스를 입자화하여 필터로 처리하는 연구가 진행되고 있다.2) 입자화의 방법을 촉진하기 위한 방안으로 오존을 투입하여 입자화를 촉진하는 방법이 있으나, 이 방법은 오존의 2차 오염원이 발생하고 오존생성기의 고가로 인하여, 오존의 투입은 어려운 상황이다.3) 이를 해결하기 위해 농도가 낮은 과산화수소를 이용하여, 입자화를 촉진하는 방법이 있다. 본 연구는 입자화를 촉진하기 위한 과산화수소 투여에 따른 질소산화물의 산화·환원 메커니즘을 규명하고자 한다.
2. 질소산화물의 반응 메커니즘
Table 1에 나타낸 헨리 상수로 NO2, HNO2, HNO3까지 더 산화함으로써 질소 함유 가스의 용해성을 대폭 향상시킬 수 있다. 이는 완전히 산화된 질소 종이 여러 발전소의 기존 습식 스크러버에서 SO2와 동시에 또는 폐기물 소각로의 기존 건식 스크러버에서 염화수소(HCl)와 함께 흡수될 수 있다. 일산화질소는 오존(O3) 또는 Hydroxyl radicals (OH)를 사용하여 저온에서도 산화가 가능하다.4-5)
| (1) |
| (2) |
| (3) |
| (4) |
| (5) |
반응 식 (1)~(5)를 보면 일산화질소와 오존의 화학반응식이다. 오존(O3)은 NO를 NO2로만 산화하는데 비해 OH radical은 NO를 NO2 및 HNO3으로 산화한다. HNO2와 HNO3 모두 NO나 NO2보다 훨씬 용해성이 높다.6) 따라서 일반 스크러버에서의 NOx 제거는 오존(O3)보다 OH radical이 더 용이하다.7) 또한 오존은 대기환경오염 물질 중 하나이며, 질소산화물이나 휘발성 유기화합물(VOCs)이 태양광선을 받아 화학반응을 일으켜 발생하고 인체에 유해성이 높아 바람직하지 않다.8-10) 따라서 대체제로 과산화수소를 사용하여 질소산화물을 저감하고자 한다. OH radical을 생성하는 한 가지 방법은 과산화수소의 열분해이다. 고온 가스 흐름에 주입된 과산화수소는 다음 반응식 (6)~(9) 중 하나 이상에 따라 분해될 수 있다.
| (6) |
| (7) |
| (8) |
| (9) |
처음 두 반응 중 반응식 (7)은 HOO-H 결합을 끊어내는 필요한 에너지가 HO-OH 결합을 끊어내 는 에너지보다 훨씬 크기 때문에 발생할 가능성이 적다고 판단된다.11) 불균일한 분해 반응식 (8)은 표면에서 쉽게 발생하며, 약 400℃ 미만의 온도에서 주로 발생된다.12)
| (10) |
| (11) |
NO의 최적 산화비는 NO 전환 생성물물에 의해 결정되었는데, 이는 다양한 생성물의 용해 특성이 상이하기 때문이다. H2O2 열분해에 의한 NO산화의 주요 생성물은 NO2, HNO2, HNO313) 산화생성물이 주로 NO2인 경우, 물에 NO2가 용해되면 NO가 재생되기 때문이다 (반응식 10). 높은 산화비는 NOx의 저감에 도움이 되지 않을 수 있다고 한다.
| (12) |
| (13) |
| (14) |
| (15) |
또 다른 연구에서는 NO 산화비가 50~70%일 때 알칼리성 용액에서 NO 가스 흡수율이 가장 높다는 것을 발견하였다.14) NO와 NO2의 몰 량은 용해에 도움이 되기 때문에 H2O2 주입 후 NO 농도가 크게 감소하였으며, NO의 감소와 NO2 농도가 증가하였다.
반응은 H2O2의 분해로 시작하여 OH와 H2O2는 빠르게 NO2로 전환된다. 반응속도가 느리기 때문에 반응식 (14)는 주요 반응이 아니다.15)
따라서 본 연구에서는 과산화수소의 활성 OH 라디칼을 활용하여 NO와 NO2를 산화하여 NOx 제거 효율과 액상의 과산화수소 농도에 따른 산소발생량을 보고자 한다.
3. 실험장치 및 조건
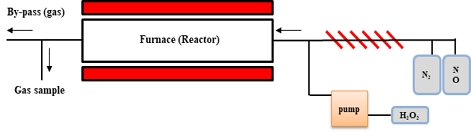
Fig. 1은 본 연구에서 이용한 NOx 저감 장치의 개략도이다. 장치는 N2와 NO를 투입하는 가스 공급장치와 공급라인에 공급가스를 예열해줄 과열기가 구성되어있으며, 과산화수소 투입할 정밀펌프(Eldex Optos pump, Model 3: High Pressure Liquid metering pump (0.01 – 80 mL/min, 3,000 psi max.)와 반응기 투입 직전에 공급라인이 이어져있는 구조를 지니고 있다. 반응기는 Sus 재질과 Quartz 재질의 두 가지 반응기가 있으며, 열원은 전기 퍼니스를 사용하였다. 반응 후 가스는 ECOM-MK9000 모델의 가스분석기로 반응 후의 NO, NO2, NOx, O2를 실시간으로 측정하였다(Fig. 1 & Fig. 2).
과산화수소 수용액이 온도 및 mole 수에 따라 발생하는 산소발생량을 측정하였다. 수용액의 농도는 5~15% 농도로 맞추어 반응기 200~500℃에서 액상으로 정밀 펌프(Eldex Optos pump, Model 3)를 이용하여 투입하였다.
각 온도 및 mole 수에 따른 산소발생량을 참고하여, NO gas에 H2O2 수용액을 H2O2/NO ratio 및 온도에 따라 발생하는 NOx의 농도 변화를 측정하였다. 실험에 사용된 가스는 먼저, carry gas로는 N2 gas를 사용하였으며, NO는 500 ppm 농도의 가스를 사용하였다. 과산화수소 용액은 DUKSAN사의 농도 28%를 사용하였으며, 과산화수소의 농도는 희석 및 시간당 투입량을 계산하여 투입하였다. 투입 방식은 위에서 아래로 떨어지도록 drop-top 방식으로 투입하였다.
4. 실험 결과 및 고찰
4.1 Sus 반응기의 과산화수소 투입 O2 발생 결과
Sus 반응기에서 과산화수소 투입 시 산소발생량의 영향력 차이를 비교하기 위 측정하였다. 실험 조건은 Table 2와 같이 농도 5~10, 15%의 과산화수소를 투입하였으며, 온도는 200~500℃로 진행하였다.

H2H2 (conc. 5~15%) Measurement concentration and calculation value of oxygen generation due to pyrolysis
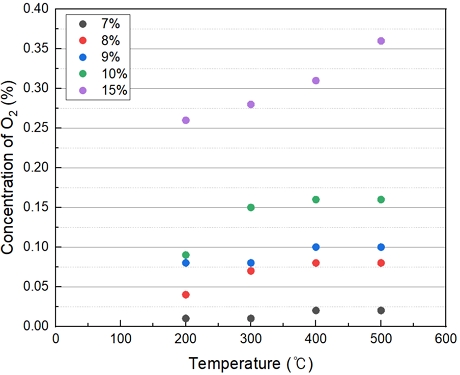
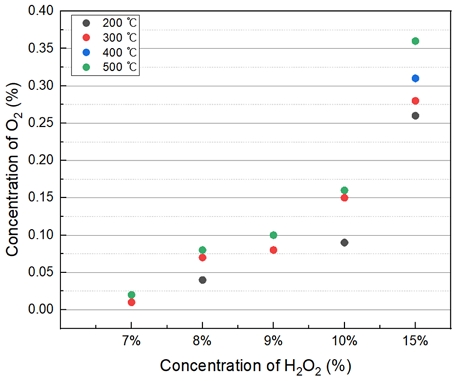
Table 2는 과산화수소 투입 농도에 따른 산소 발생량을 측정하였다. 5% H2O2의 경우 O2가 측정되지 않았으며 7% H2O2부터 O2가 발생했다. 15%의 H2O2를 투입했을 때, 계산된 값으로 47%로 3,600 ppm이 발생하였다. 온도 및 H2O2 농도가 상승할수록 O2의 발생량이 증가하는 경향을 보였다.
Fig. 3의 경우 반응온도에 따른 H2O2 열분해 발생으로 인한 산소발생량과 H2O2 투입농도에 따른 산소발생량에 대해 나열하였다. H2O2 투입농도가 15%일 때, 온도가 상승할수록 산소발생량이 증가하는 경향은 보이나, 반응 온도에 의한 산소발생의 영향력은 크지 않은 것으로 보인다.
Fig. 4는 H2O2 투입농도에 따른 O2 발생량을 나타내었다. H2O2 15%의 농도는 상당히 높으며, 7~10%는 모든 온도가 비례적으로 산소 발생량이 증가하는 경향을 보인다.
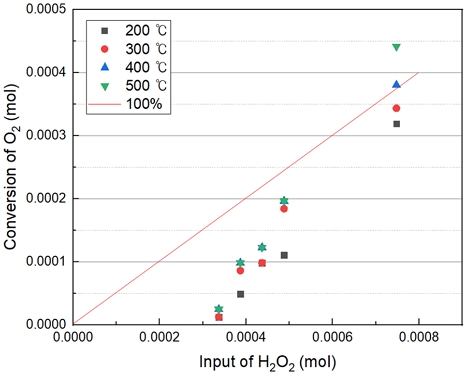
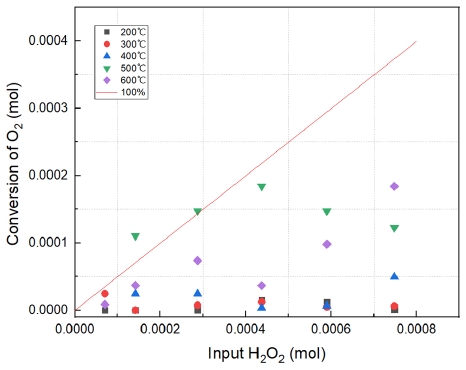
Fig. 5에서의 직선 그래프는 이론적으로 100% 전환되었을 때를 의미한다. Fig. 5와 Table 3은 15% H2O2, 400℃ 이상에서는 100%의 전환하는 결과를 보였다. 또한 400℃ 이상에서는 큰 전환율의 변화가 없는 것으로 보아 H2O2가 400℃에서 모두 분해된다고 판단된다. H2O2의 농도가 높을수록 많은 양의 산소 발생의 결과를 보였다. 따라서 반응온도는 산소발생에 있어서 큰 영향을 주지 않은 것으로 보인다.
4.2 Quartz 반응기의 과산화수소의 O2 발생 결과
Quartz 반응기, 300~500℃ 온도에서 H2O2 농도는 9, 12, 15% 수용액을 투입하여서 산소발생량을 분석하였다.
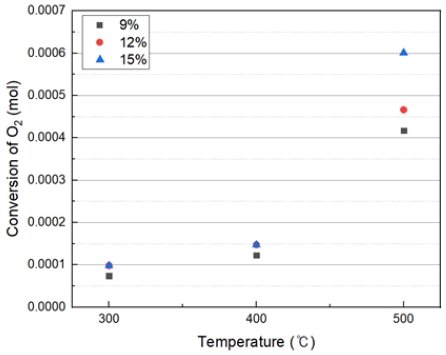
Table 4와 Fig. 6은 Quartz 반응기에서 과산화수소 수용액의 농도 9~12% 투입 시 산소 발생량 결과를 나타내었다. 500℃에서 상당한 산소발생량이 나타난다. 과산화수소 수용액을 투입할 시에 400℃ 부근 온도까지 사용하는 것이 적절하다고 판단된다. 또한 500℃에서 100%가 초과한 이유는 수분 발생에 의해 초과한 것으로 보인다. 따라서 H2O2가 H2O로 분해되어 수분 Trap 설치가 필요하다고 판단된다.(반응식 8)11)
온도가 증가함에 따라 전환되는 산소량이 점진적으로 증가하는 경향을 보여 주고 있다. 온도 500℃에서 급격하게 산소가 증가하는 경향이 나타났으며, 300~400℃ 과산화수소 수용액 농도의 차이에 큰 산소발생량의 차이는 보이지 않는다.
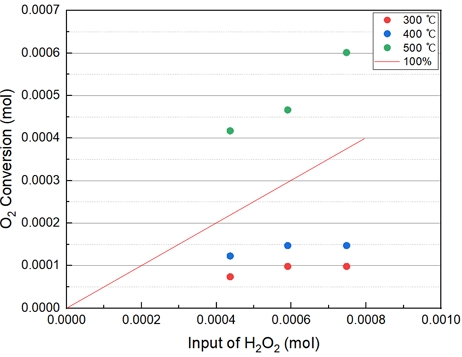
Fig. 7에서의 직선 그래프는 이론적으로 H2O2가 O2 100% 전환되었을 때를 의미한다. 400℃ 이하 온도에서는 H2O2 투입 몰 수가 증가하여도 차이가 없다. 500℃ 이상 온도에서는 투입 몰 수와 관계없이 급격히 증가하는 경향을 보인다. 따라서 과산화수소 투입 몰 수에 대한 산소발생량은 큰 차이가 없으나, 500℃ 부근 온도에서는 투입 몰 수에 관계 없이 높은 산소 발생시키는 것을 확인하였다.
4.3 Sus 반응기와 Quartz 반응기 비교
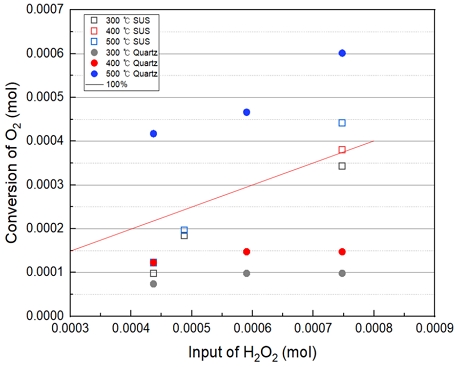
Fig. 8은 앞서 설명한 Sus와 Quartz 반응기의 H2O2 수용액 투입 시 온도 및 투입 몰 비에 따른 산소 발생량 결과를 비교하였다.
Sus 반응기는 투입 몰 수가 증가하고, 온도가 증가할수록 산소발생량이 급격히 증가하는 경향을 보인다. 반면 Quartz 반응기는 400℃ 부근까지는 투입 몰 수에 따른 차이는 크지 않지만, 500℃에서는 산소 발생량이 크게 발생하는 경향을 확인하였다.
이러한 결과를 보아, Drop-top 방식으로 반응기에 과산화수소 수용액을 투입할 시에 Sus 반응기는 투입 몰 수 및 온도에 따라 산소발생량이 급격히 증가하여 불안정하다고 판단된다. 반면 Quartz 반응기가 산소발생량 차이가 작다. 과산화수소 수용액을 투입에는 SUS보다 유리한 것으로 판단된다. 이후 실험은 Quartz 반응기를 사용하여 실험을 수행하였다.
4.4 H2O2 투입 비에 따른 NO 산화 결과
온도 및 H2O2 농도에 따른 NO의 산화 특성을 분석하기 위해 H2O2/NO ratio를 0.5, 1, 2, 3, 4, 5 비율로 실험을 진행하였으며 NO는 500 ppm으로 고정하여 투입하였으며, carry gas는 N2를 사용하였고 MFC를 이용하여 모든 가스를 투입했다. 총 유량은 3,000 sccm으로 투입하여 진행하였다. 반응 후 가스는 가스분석기(ECOM-MK9000)으로 실시간으로 NO, NO2, NOx, O2를 측정하였다.
Fig. 9~13은 온도 200, 300, 400, 500, 600℃에서 H2O2/NO ratio를 0.5, 1, 2, 3, 4, 5 비율로 투입했을 때의 결과이다. NO는 초기 농도에서 감소된 농도, NO2는 NO2로 전환된 농도, 총 NOx 저감 농도를 그래프에 나열하였다.
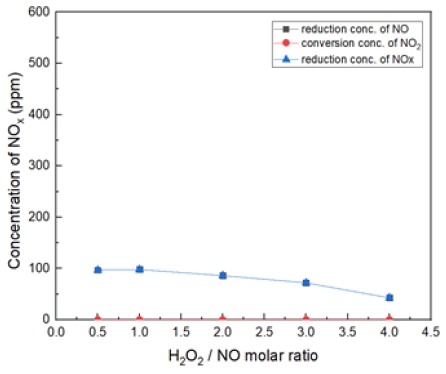
Fig. 9는 반응 온도 200℃, H2O2/NO ratio 0.5~4.0을 투입했을 때 NO 감소 농도, NO2 전환 농도, NOx 저감 농도를 나타내었다. 반응 후 NO2 전환된 것은 없으며, NO가 S.R(Shoot/Root ratio)비가 더 적을 때 오히려 저감되는 것을 확인하였다.
Fig. 10은 온도 300℃에서 H2O2/NO ratio를 0.5~5.0 비율로 투입했을 때의 결과이다. 200℃보다 SR이 증가할수록 NO 농도감소 및 NOx 저감이 증가하는 경향을 보였다. NO2는 SR = 5일 때, 약 100 ppm으로 전환되는 것을 확인하였다.
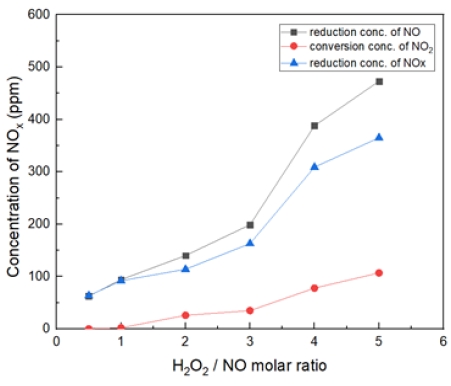
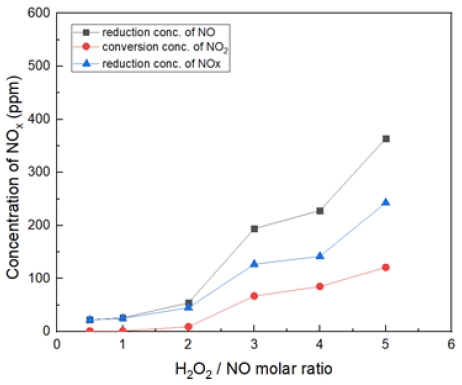
Fig. 11은 온도 400℃에서 H2O2/NO ratio를 0.5~5.0 비율로 투입했을 때의 결과이다. 400℃에서는 S.R = 3 비율부터 NO가 450 ppm 저감되는 것을 확인했다. 마찬가지로 NOx 저감도 증가한다. S.R = 5일 때, NO2가 약 150 ppm으로 전환되는 것으로 확인하였다.
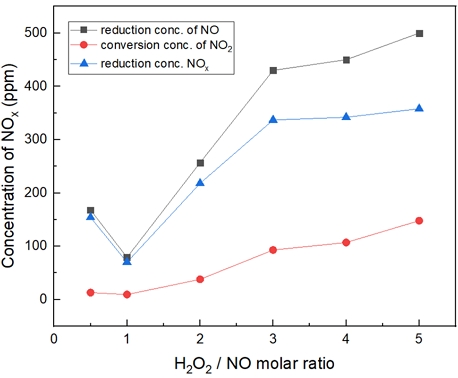
Fig. 12는 온도 500℃에서 H2O2/NO ratio를 0.5~5.0 비율로 투입했을 때의 결과이다. 500℃에서는 S.R 비가 증가할수록 NO 농도감소 및 NOx 저감, NO2 전환되는 것이 증가되지만, S.R비 3, 4의 경우 400℃보다 효율이 좋지 못한 것을 확인하였다.
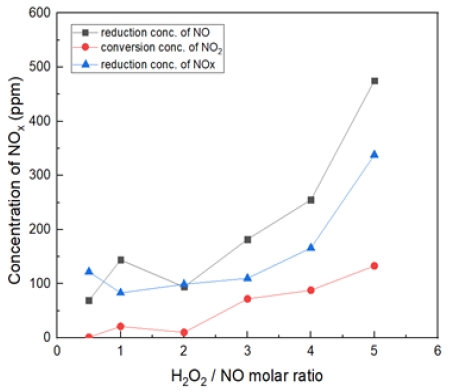
Fig. 13은 온도 600℃에서 H2O2/NO ratio를 0.5~5.0 비율로 투입했을 때의 결과이다. 600℃에서 비례적으로 NO 감소 및 NO2 전환, NOx 저감 증가하는 경향을 확인하였다. 500℃일 때와 비슷한 경향이나 효율은 감소되는 것으로 확인된다. 9% H2O2 용액 투입 경우에는 300, 400℃에서 Sus와 Quartz 반응기 유사한 결과를 나타났다. 이 온도구간 반응 온도 300~600℃는 S.R이 올라갈수록 NO의 산화가 증가되는 경향을 보였다. 400, 500℃에서의 S.R = 0.5에서는 NO의 농도 감소가 큰 폭으로 증가하여 낮은 S.R의 영향인지 확인하기 위해 S.R = 0.25를 추가하여 진행했으나, 정상적인 NO2 전환 및 NO 농도 감소를 보였다.
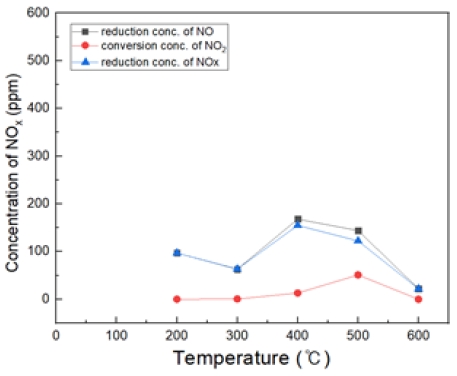
온도 및 H2O2 농도가 높을수록 (NO 농도감소 / NO2의 전환율)이 높게 나타나는 것을 확인하였다. 특히, 400℃ 구간에서 가장 높은 NO 저감률을 보여주었다. S.R = 3 조건에서 가장 높은 효율을 보였다.
Fig. 14~19는 H2O2/NO ratio를 0.5, 1, 2, 3, 4, 5 비율로 투입했을 때 각 반응온도에 따른 결과이다. NO는 초기 농도에서 감소된 농도, NO2는 NO2로 전환된 농도, 총 NOx 저감 농도를 그래프에 나열하였다.
Fig. 14는 H2O2/NO ratio 0.5, 반응 온도 200~600℃에서의 투입했을 때 NO 감소 농도, NO2 전환 농도, NOx 저감 농도를 나타내었다. 대체적으로 400℃에서 가장 많은 NO 농도가 감소되는 것을 확인하였다. 반응온도 200℃가 300℃보다 더 NO 감소 농도가 높고, 400℃ 이후 고온에서는 점점 효율이 감소되는 경향을 확인하였다.
Fig. 15는 H2O2/NO ratio 1.0, 반응 온도 200~600℃에서의 투입하였다. 대체적으로 NO 산화 효율이 상당히 좋지 않으며, 반응 온도 500℃에서 제일 높은 효율을 보여 주었으며, 그 이상 온도에서는 급격하게 효율이 저하되었다.
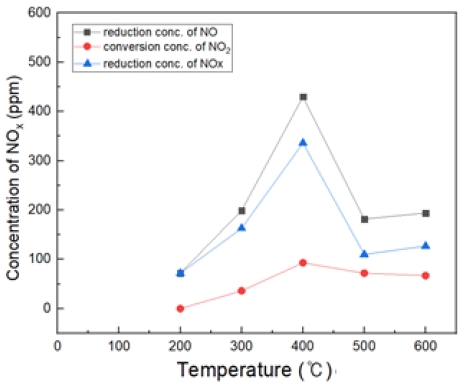
Fig. 16은 H2O2/NO ratio 2.0, 반응 온도 200~600℃ 에서의 투입하였다. 대체적으로 400℃에서 가장 많은 NO 농도가 감소되는 경향을 보여 주었다.
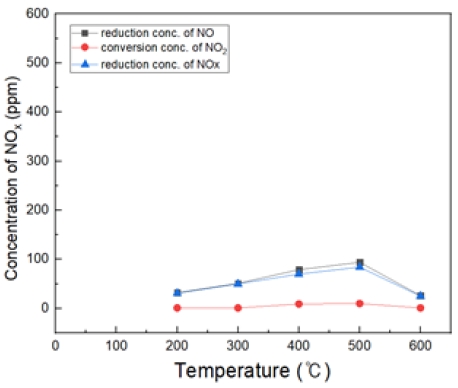
Fig. 17은 H2O2/NO ratio 3.0, 반응 온도 200~600℃ 에서의 투입하였다. 대체적으로 400℃에서 가장 많은 NO 농도가 감소되는 것을 확인할 수 있었고, S.R = 2일 때와 유사하나 효율이 더 좋게 나왔다.
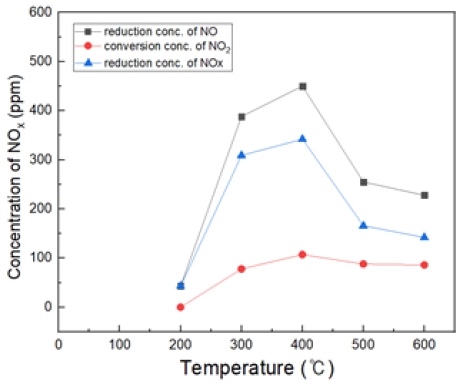
NO2 전환되는 것에 비해 NO가 저감되는 것으로 보아, 이는 N2 및 HNOx 가스 상으로 전환 및 수분으로 빠져나가는 것으로 추측된다. (반응식 8)
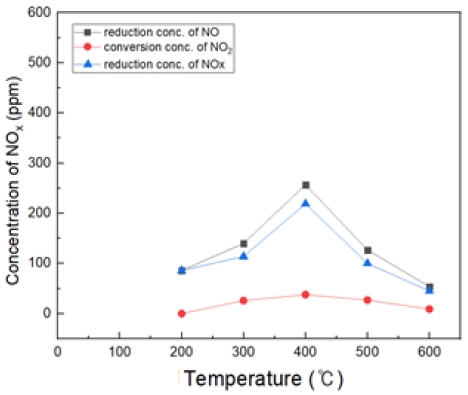
Fig. 18은 H2O2/NO ratio 4.0, 반응 온도 200~600℃에서의 투입하였다. 마찬가지로 400℃에서 가장 많은 NO 농도가 감소되는 것을 확인할 수 있었고, 반응온도 500, 600℃에서는 산화 효율이 감소되는 것을 확인하였다.
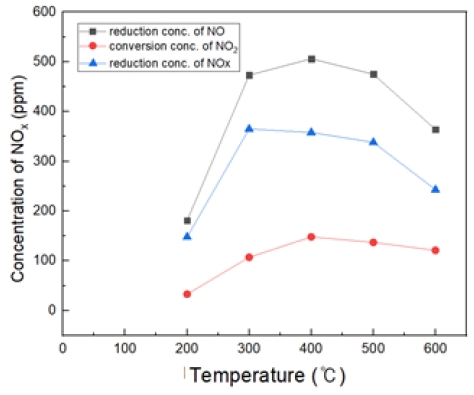
Fig. 19는 H2O2/NO ratio 5.0, 반응 온도 200~600℃에서의 투입하였다. 마찬가지로 400℃에서 가장 많은 NO 농도가 감소되는 것을 확인할 수 있었지만 높은 과산화수소 비율로 300, 500℃에서도 산화 효율이 약간 증대되는 것을 확인하였다. 하지만 200℃에서는 효과가 저조한 것으로 보인다.
Fig. 20과 Table 5는 H2O2 투입 몰 비 및 반응온도 200~600℃에서의 산소발생량을 총 나열하였다.
온도 500℃, S.R = 0.5, 1을 제외하고 모두 100% 전환율 이하에서 측정되는 결과를 보였다.(Table 5) 산소발생량은 대체로 500, 600℃ 고온에서 많이 발생하는 경향으로 보여진다.
5. 결 론
본 연구는 NOx 입자화 과정 중 중간단계로 NO를 산화시켜 N2나 HNO2, HNO3 가스로 전환시키는 목적으로 NOx를 저감하는 것이다.
1) H2O2의 열분해로 인한 OH 라디칼 반응으로 산소 발생량 및 NO 산화 실험을 진행하였다. H2O2 수용액을 투입 시에는 SUS 재질의 반응기보다 Quartz 재질의 반응기가 반응성에 훨씬 더 안정적이다. 과산화수소의 가장 높은 반응성은 반응 온도 400℃이다.
2) H2O2/NO 비율은 3 이상일 경우부터 산화가 잘되는 것을 확인하였다. 높은 NO2 전환율은 반응온도 400℃ NO 저감은 S.R = 3일 때, 최대 40%의 효율을 이루어냈다.
3) 반응이 고온으로 상승하는 경우, H2O2가 열적 크래킹으로 인해 더 훨씬 분해되어, NO 산화를 더 좋지 않게 만드는 경향이 있고, 수분 발생으로 인해 산소발생량이 상당히 증가하는 것을 고려해야 한다.
4) 과산화수소 수용액 투입은 반응온도가 400℃ 부근까지 사용하는 것이 바람직하며, H2O2 농도가 15% 이상으로 높지 않게 사용하는 것을 제안한다.
Acknowledgments
This work was supported by the Korea Institute of Energy Technology Evaluation and Planning(KETEP) amd the Ministry of Trade, Industry & Energy(MOTIE) of the Republic of Korea(No. 2018110200170).
Author contributions
J. H. Yoon; Conceptualiztion & Data curation. J. S. Kim; Formal analysis & Investigation. S. C. Choi; Supervision.
References
- S. Y. Park, 2013, “Impact of Ash Deposit on Conversion Efficiency of wall Flow Type Monolithic SCR Reactor”, Journal of Power System Engineering, 17(1), 27-29.
-
J. G. Anderson, J. J. Margitan and F. Kaufman, 1974, “Gas phase recombination of OH with NO and NO2, The Journal of Chemical Physics”, 60(8), 3310-331718.
[https://doi.org/10.1063/1.1681522]
-
Y. J. Hwang et al., 2020, “Direct conversion NO and SO2 in flue gas into fertilizer using ammonia and ozone”, Journal of Hazardous Materials, Vol. 397, 2-3.
[https://doi.org/10.1016/j.jhazmat.2020.122581]
- D. C. Chao, 1994, “Kinetic Modeling of the Hydrogen Peroxide or Ozone Enhanced Incineration of Nitric Oxide and/or Carbon Monoxide”, Master's Thesis. University of Central Florida: Orlando, FL.
-
R. M. Counce, J. J. perona, 1983, “Scrubbing of gaseous nitrogen oxides in packed towers”, AICHE Journal, 29(1), 26.
[https://doi.org/10.1002/aic.690290104]
- J. W. Harrison, 1976, “Technology and Economics of Flue Gas NOx Oxidation by Ozone”, U.S. Environmental Protection Agency. U.S. Government Printing Office: Washington, DC, EPA-600/7-76-033. 33-39. (https://nepis.epa.gov/Exe/ZyPURL.cgi?Dockey=9101DUK2.txt, )
- C. H. Shen and G. T. Rochelle, 1993, “NO2 Absorption into Sulfite Solutions”, Progress Report Department of Chemical Engineering, University of Texas at Austin, 9/92-9/93.
-
H. D. Perlmutter, H. Ao, H. Shaw, 1993, “Absorption of NO promoted by strong oxidizing agents: Organic tertiary hydroperoxides in n-hexadecane”, Environmental Science and Technology, 1(27), 129-131.
[https://doi.org/10.1021/es00038a013]
-
D. Littlejohn and S. G. Chang, 1990, “Removal of NOx and NO2 from flue gas by peracid solutions”, Journal of Industrial and Engineering Chemistry, 7(29), 1421-1422.
[https://doi.org/10.1021/ie00103a047]
- H. B. H. Cooper, 1984, “Removal and recovery of nitrogen oxides and sulfur dioxide from gaseous mixtures containing them”, U.S. Patent 4426364A.
- R. T. Sanderson, 1989, “Simple Inorganic Substances”, Robert E. Krieger Publishing Company: Malabar, FL.
-
C. N. Satterfield and T. W. Stein, 1957, “Homogeneous decomposition of hydrogen peroxide vapor”, Journal of Physical Chemistry, 5(61), 537.
[https://doi.org/10.1021/j150551a006]
-
P. Limvoranusorn et al., 2005, “Kinetic modeling of the gas-phase oxidation of nitric oxide using hydrogen peroxide”, Journal of Environmental Engineering, 131(4), 518-525.
[https://doi.org/10.1061/(ASCE)0733-9372(2005)131:4(518)]
-
D. Thomas and J. Vanderschuren, 2000, “Nitrogen oxides scrubbing with alkaline solutions”, Chemical Engineering & Technology, 23(5), 449-455.
[https://doi.org/10.1002/(SICI)1521-4125(200005)23:5<449::AID-CEAT449>3.0.CO;2-L]
-
R. S. Zhu and M. C. Lin, 2003, “Initio study of the HO2+NO reaction: Prediction of the total rate constant and product branching ratios for the forward and reverse processes”, The Journal of Chemical Physics, 119(20), 10667-10677.
[https://doi.org/10.1063/1.1619373]